Es soll Anfang 2014 gewesen sein, als der Doktorand Samuel Sternberg aus Jennifer Doudnas Labor an der University of California in Berkeley von einer Geschäftsfrau zu einem obskuren Lunch eingeladen wurde: Die Dame interessierte sich für eine revolutionäre gentechnische Methode, die Doudna knapp zwei Jahre zuvor mit der Französin Emmanuelle Charpentier veröffentlicht hatte.
Das molekularbiologische Werkzeug, Crispr-Cas genannt, erlaubt es, einfach und in großer Zahl Änderungen im Erbgut von Lebewesen vorzunehmen - auch in dem von Menschen. Bei mexikanischen Cocktails unterbreitete die Unternehmerin dem jungen Forscher daher ihre Idee: Sie wolle Paaren mit Erbkrankheiten in einem kommerziellen Start-up zu per Crispr-Technik genetisch reparierten Crispr-Babys verhelfen. Sternberg sollte sie mit seinem Know-how dabei unterstützen.
Einem US-Forscher ist es gelungen, mithilfe der Gentechnik Erbkrankheiten in menschlichen Embryonen zu beheben. In Deutschland dreht sich die Debatte jedoch im Kreis.
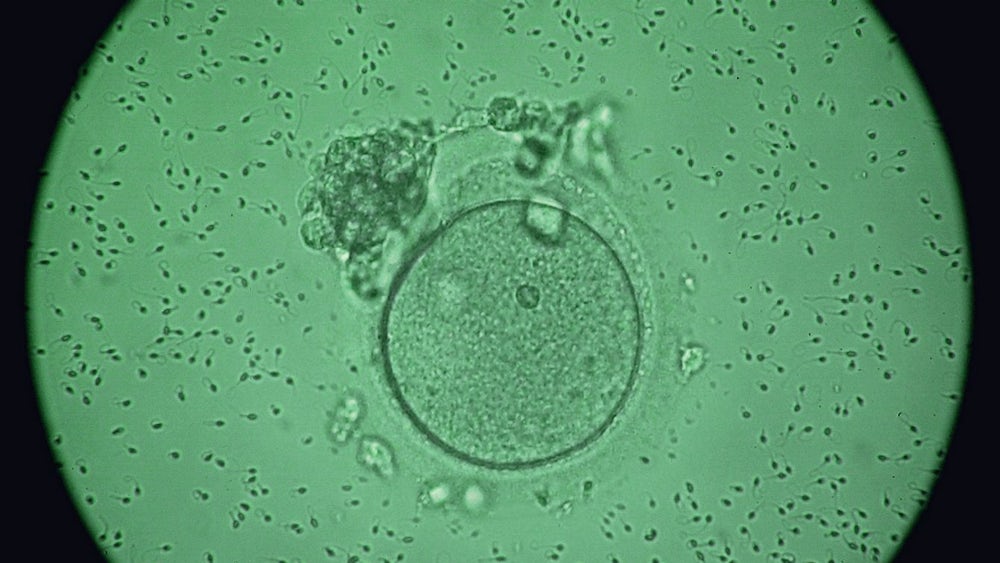
Für Sternberg, der das Restaurant fluchtartig verließ, und auch für Jennifer Doudna war dieses Angebot damals ein Erweckungserlebnis. Insbesondere Doudna hat sich nach eigener Aussage immer gefragt, wie weit andere Forscher wohl gehen würden mit dieser Technik, deren Existenz sie mitzuverantworten hat und deren Anwendung an menschlichen Embryonen keineswegs mehr Science-Fiction ist, wie nun eine Arbeit im Wissenschaftsjournal Nature beweist: Erstmals haben Forscher lebensfähige Embryonen mithilfe von Crispr erfolgreich genetisch verändert, und zwar so effektiv, dass sich ein Teil der künstlich befruchteten Eizellen im Labor normal entwickelte. Den gesunden, von einem erblichen Herzmuskeldefekt des Vaters befreiten Zellkugeln fehlte eigentlich nur noch eines, um zu einem richtigen Embryo und schließlich zu einem Crispr-Baby heranwachsen zu können: eine Mutter, die sie austrägt.
So weit sind die Forscher nicht gegangen, die Embryonen wurden nach wenigen Tagen für weitere Untersuchungen zerstört. Doch diskutiert wird über die Bedeutung der Arbeit schon seit Tagen. Bereits vergangene Woche war bekannt geworden, dass das Team um Shouhkrath Mitalipov von der Oregon Science and Health University in Portland seine Experimente mit großem Erfolg abgeschlossen hatte. Nun, da die Details schwarz auf weiß vorliegen, ist klar, dass das Crispr-Baby überraschend greifbar ist.
Bislang hatten die wenigen verfügbaren Studien eher das Gegenteil nahegelegt. Nur in einer einzigen Arbeit war bislang an lebensfähigen Embryonen experimentiert worden, und das mit bedenklich hohen Fehlerquoten durch genetische Veränderungen an Stellen im Genom, die durch den Eingriff gar nicht verändert werden sollten. Solche Off-Target-Effekte gelten als ein Hauptproblem von Crispr-Cas. In Embryonen kommt es außerdem nicht in allen Zellen zu einer gewünschten Korrektur. Dadurch entstehen biologische Mosaike aus krankem und gesundem Gewebe.
Viele Fachleute hielten es wegen dieser Probleme für sehr unwahrscheinlich, dass Erbdefekte mit der Crispr-Genschere bald sicher zu korrigieren sein würden. Mitalipovs Team aber plante seine Versuche äußerst bedacht. Zunächst testeten die Forscher ihr Werkzeug systematisch, unter anderem an Stammzellen des herzkranken Samenspenders, um zu messen, wie präzise die Korrektur im Erbgut erfolgt. Für die eigentlichen Versuche nutzten sie schließlich einen Trick, der die Mosaikbildung im Embryo verhindern sollte: Die Biomediziner nahmen die Crispr-Behandlung nicht erst nach der künstlichen Befruchtung der Eizellen vor, sondern bereits im Moment der Befruchtung, während das Spermium in die Eizelle eindrang.
Das verhalf ihnen zu dem erstaunlichen Erfolg. In 42 von 58 Embryonen wurden das Gen für die Herzmuskelschwäche korrekt korrigiert. Nur bei einem trat ein Gewebemosaik auf. Off-Target-Mutationen konnten die Forscher in den korrigierten Embryos nicht aufspüren. Fachleute warnen jedoch davor, diese Resultate zu zeitig zu bejubeln. "Meiner Ansicht nach ist es für eine abschließende Aussage zu früh", sagt Jan Korbel vom European Molecular Biology Laboratory. "Es ist noch unklar, ob dieses Ergebnis bestehen bleibt, wenn verbesserte Verfahren zum Aufspüren von Off-Target-Effekten angewendet werden." Die Forscher erzeugten die Embryos für das Experiment zudem lediglich mit den Spermien eines einzigen Mannes, der womöglich zufällig besonders günstige Voraussetzungen für das Experiment mitbrachte. "Hätten wir verschiedene Spender genutzt, hätten wir auch deutlich mehr Embryonen herstellen und verbrauchen müssen", erklärte Mitalipov am Dienstag während einer Pressekonferenz diesen Umstand.
"Kaum einen Fortschritt gegenüber der klassischen PID"
Das bedeutet jedoch, dass weitere Versuche die amerikanischen Resultate bestätigen müssen, was aber selbst in Ländern mit fortschrittlicher Gesetzgebung schwierig sein dürfte: In einigen Staaten ist die Forschung an Embryonen zwar erlaubt, jedoch nur an überzähligen Embryonen aus künstlichen Befruchtungen. Diese werden jedoch üblicherweise mehrere Tage nach der Befruchtung eingefroren und eignen sich daher nicht für Mitalipovs Methode, die noch vor der Verschmelzung von Ei- und Samenzelle ansetzt.
Ausgerechnet in Deutschland wäre die Lage womöglich anders, weil nur Embryonen im sogenannten Vorkernstadium eingefroren werden dürfen, also befruchtete Eizellen, deren Kern noch nicht mit dem Spermium verschmolzen ist. Derzeit ist Forschung an diesen Gebilden in Deutschland zwar verboten. Mehrfach haben sich deutsche Forscher aber dafür eingesetzt, mit überzähligen Embryonen arbeiten zu können und dabei auch gentechnische Verfahren einzusetzen. "Viele sehen es nicht ein, dass Embryonen, die keine reale Lebenschance haben, zwar weggeworfen werden, aber nicht unter bestimmten Voraussetzungen für hochrangige Forschungsziele verwendet werden dürfen", sagt der Jurist Jochen Taupitz von der Universität in Mannheim. Letztlich werde der Gesetzgeber die Frage entscheiden müssen. Und das wohl schon bald, denn in der Forschung wachsen die Begehrlichkeiten.
Über eine praktische Anwendung in der Klinik zu reden, so, wie es die Autoren der Studie vorschlagen, dafür sehen die Fachleute derzeit jedoch keine Veranlassung. Denn ja, das Crispr-Baby ist greifbar - aber ist es auch die bessere Option für erbkranke Menschen, die gesunde Kinder haben wollen? Trotz technischer Kniffe und extrem niedriger Fehlerrate traten auch in den Versuchen in Portland noch Reparaturdefekte auf. "Alle entstehenden Embryonen müssten bei einer praktischen Anwendung mittels Präimplantationsdiagnostik (PID) getestet und gegebenenfalls aussortiert werden", sagt Klaus Rajewsky vom Max-Delbrück-Centrum für Molekular Medizin in Berlin. "Das heißt praktisch, dass diese Methode kaum einen Fortschritt gegenüber der klassischen PID bringt."
Zumindest jetzt noch nicht. Man sollte allerdings die Unternehmerin nicht vergessen, die Sam Sternberg vor drei Jahren ihr unmoralisches Angebot unterbreitete. Nicht jeder Wissenschaftler flüchtet, wie Sternberg es tat. Es gibt auch unter Forschern jene, die weiterreden. Und dann wäre es gut, die rechtlichen Grenzen schon längst gezogen zu haben.