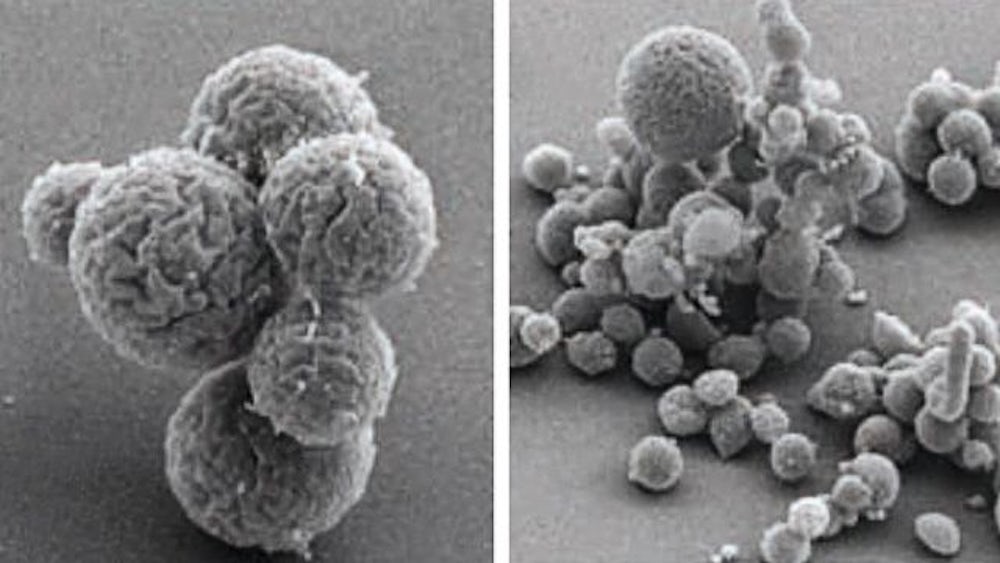
Mehr als 70 Seiten umfasst die Anleitung, mit der man das Lebewesen mit dem kleinsten Genom der Welt erschaffen kann. Eine Gruppe von Biotechnologen um Craig Venter, Amerikaner und Enfant terrible der Wissenschaft, veröffentlichte am Freitag diese Gebrauchsanweisung im Fachblatt Science. Die Forscher hatten die Erbanlagen eines Bakteriums am Computer auf das Wesentliche zusammengekürzt, dann schalteten sie Maschinen ein, die das künstliche Genom produzierten, und schleusten es in Bakterienzellen ein. Dort übernahmen die neuen Gene die Kontrolle, der biologische Neustart einer seit Jahren angekündigten Minimalmikrobe ist geglückt. Venter nennt die Kleinstkreatur aus dem Labor "Syn 3.0". Es geht ihm um nicht weniger als die Vermessung des Lebens. "Unser Ziel", heißt es in der Studie, "ist eine Zelle, die so simpel ist, dass wir die molekulare und biologische Funktion jedes einzelnen Gens bestimmen können."
Doch mit Zielen ist es so eine Sache. Schon lange hatte die Fachwelt auf Venters Mikrobe gewartet. Spätestens seit er 2010 die Erschaffung der ersten synthetischen Zelle veröffentlicht hatte. Die Nachricht sorgte damals für Schlagzeilen. Im Grunde handelte es sich um eine leicht abgewandelte Kopie des natürlichen Bakteriums Mycoplasma mycoides, eines Parasiten, der Wiederkäuer befällt. Doch war es tatsächlich das erste Bakterium, dessen Erbgut vollständig am Computer entworfen und dann im Labor von Maschinen aus vier biochemischen Grundbausteinen zusammengesetzt worden war. Auf dem Weg zum Minimalorganismus musste "Syn 1.0" eigentlich nur noch verbessert und vor allem genetisch entrümpelt werden.
Das Leben vom Reißbrett war zunächst eine Totgeburt
Jeder Organismus schleppt in seinen Zellen Erbanlagen herum, die keine Funktion mehr haben. Dieser genetische Ballast hat sich im Lauf der Evolution angesammelt. Manche dieser Altlasten waren vielleicht einmal überlebenswichtig, wurden dann aber durch Mutationen unbrauchbar oder unter veränderten Lebensbedingungen nutzlos. Andere Gene sind zwar in der freien Wildbahn wichtig, aber nicht in der Petrischale im Labor. Viele vitale Funktionen einer Zelle werden zudem von mehreren Genen übernommen. Manche dieser Redundanzen sind wichtig, andere verzichtbar.
Doch sechs Jahre nach den Schlagzeilen um künstliches Leben aus Venters Labor ist klar, dass die Schrumpfung eines Genoms alles andere als einfach ist. Die Veröffentlichung in Science liest sich über Seiten auch als ein Dokument des Scheiterns, eine neue Erfahrung für den erfolgsverwöhnten Multimillionär Venter. So hatten die Forscher zunächst gedacht, ihr genetisches Wissen reiche aus, um ein kürzeres Erbgut einfach am Computer zu entwerfen.
Die moderne Biologie beschränkt sich schon lange nicht mehr darauf, die Natur zu beschreiben - manche Wissenschaftler haben inzwischen schon das Ziel, selbst Organismen mit neuen Eigenschaften herzustellen. Doch wer in die Abläufe des Lebens eingreift, muss die Grenzen seines Tuns sorgfältig abwägen.
Doch das Leben vom Reißbrett war eine Totgeburt. Also begannen die Forscher von vorne. In jahrelanger Kleinarbeit untersuchte Venters Team noch einmal, welche Gene von Syn 1.0 überflüssig erschienen und entwarfen mit diesen Erkenntnissen ein neues Erbgut. Sie teilten es in acht Segmente und kombinierten jedes davon mit sieben unbearbeiteten Abschnitten des Bakteriums. Tatsächlich überlebten die Zellen, die nur ein Segment des neuen Erbguts enthielten. Doch als die Forscher alle acht zusammenfügten, entstand erneut keine lebende Zelle. Offenbar gab es Gene, auf die das Bakterium nur dann verzichten konnte, wenn andere Gene vorhanden waren, um den Verlust auszugleichen.
Venter hofft auf einen Milliardenmarkt für synthetische Biologie
Nach weiteren Untersuchungen fügten die Forscher daher wieder 26 Gene ein. So entstand nach einigen Hundert Fehlversuchen eine erste lebende Zelle mit verkleinertem Erbgut, Syn 2.0. In einem weiteren Schritt entfernten die Forscher dann noch einmal 42 Gene und gelangten so zu Syn 3.0. Von über 900 Mycoplasma-Genen blieben am Ende 473 übrig. Die Erbanlagen ordneten die Forscher zudem säuberlich nach ähnlichen Funktionen, das soll zukünftige Experimente mit den Mikroben einfacher machen. "Wir hätten die Zahl weiter drücken können", sagt Clyde Hutchison, der an der Entwicklung der Designermikrobe beteiligt war, "doch der Preis wäre ein langsameres Wachstum gewesen." Vor dem Hintergrund, dass diese Mikroben einmal wertvolle Substanzen für den Menschen produzieren sollen, war das für Venters Team keine Option.
Dass Venter trotz der Hindernisse an dem Projekt festhält, hat schließlich weniger mit Entdeckerdrang als mit dem möglichen kommerziellen Nutzen der Arbeit zu tun: Genetisch optimierte Einzeller, die durch ein paar Ergänzungen in ihrem Erbgut im Labor und in der Biotech-Industrie wie mikroskopische Roboter alles erledigen, was man ihnen per DNA-Code einprogrammiert. Wie in einem Baukastensystem mit Zusatzgenen ausgestattet, könnten sie zum Beispiel Medikamente herstellen, Kunststoff oder andere Chemikalien wie Biosprit, und dabei gleich noch das Treibhausgas CO₂ aus der Atmosphäre holen. Oder sie verwandeln Umweltgifte in harmlose Stoffe. Craig Venter sieht einen Milliardenmarkt für synthetische Biologie heranwachsen. Um die Konkurrenz auf Abstand zu halten, hat er bereits 2007 Patentanträge für seine damals noch hypothetischen Minimalmikroben gestellt.
Die zwar für das reine Überleben der Bakterien entbehrlichen, aber für die Ziele des Forscherteams notwendigen Erbinformationen bezeichnen Hutchison und seine Kollegen als "quasi-essenziell". Joachim Boldt vom Institut für Ethik und Geschichte der Medizin an der Universität Freiburg, der die ethische Bewertung der synthetischen Biologie erforscht, sieht in dieser Inkonsequenz einen Hinweis darauf, dass es keine Grundlagenforschung ist, was Venter und Co. antreibt, "sondern zweckgebundene Forschung, und zwar viel deutlicher, als ich bisher angenommen hatte". Das Geschaffene sei kein Minimalleben, in der Natur würde es nicht überstehen. "Es ist für ein Dasein im Labor entwickelt worden, und so produktiv, wie es die Biotechnologen für nötig halten."
Martin Fussenegger, Professor für Biotechnologie an der ETH Zürich, sieht auch keine herausragende intellektuelle Leistung hinter der Schöpfung von Syn 3.0. "Jeder Mensch in diesem Berufsfeld, dem ich 40 Millionen Dollar in die Hand drücke, kann diese Arbeit erledigen." Es sei mehr Fleißarbeit als Pioniertat. Dennoch ist Fussenegger begeistert. "Es ist doch spannend, mit so wenigen Genen eine lebende Struktur hinzukriegen. Auch wenn es eher ein Weltrekord für das Guinnessbuch ist als für die Wissenschaft."
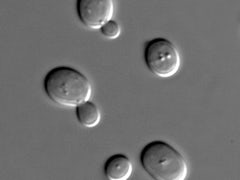
Forscher haben erstmals ein künstliches Chromosom in eine Hefezelle eingebaut. Jetzt wissen sie: Nicht jeder Abschnitt des Genoms ist notwendig. Eine "entrümpelte" DNA kann Zellen sogar zu effizienten Minifabriken machen.
Auch Joachim Boldt fand die Veröffentlichung von Venters Team vor sechs Jahren aufregender. Für Syn 1.0 hatten sie damals zwar noch kein geschrumpftes Genom, aber doch ein vollständig künstlich hergestelltes zum Leben erwecken können. Erstmals war es gelungen, aus einfachen Bausteinen das gesamte Erbgut einer Zelle nachzubauen und dieses dann die Kontrolle einer lebenden Zelle übernehmen zu lassen. Für Venter hat das nichts von göttlicher Schöpfung oder Frankenstein-Wahn, sondern ist nur die Fortsetzung von drei Milliarden Jahren Evolution. "Wir schaffen Leben nicht von Grund auf neu", erklärte er schon damals. "Wir nehmen das Material des Lebens und setzen es neu zusammen." Und am Ende brauchte sein Team auch für den jüngsten Entwicklungsschritt Starthilfe aus der Natur. Zwar produzierten die Gen-Ingenieure das Miniatur-Erbgut komplett im Labor, doch diesen knapp zwei Millimeter langen DNA-Fussel aus 531 000 Genbausteinen mussten sie noch immer in lebendige Zellen der mit M. mycoides verwandten Bakterienart M. capricolum einschleusen. Der Grund ist, dass bislang kein Mensch im Labor Zellhüllen nachbauen konnte. Oder die molekulare Maschinerie, über die selbst einfachste Einzeller verfügen, sowie die richtige Nährstofflösung in der Zelle.
Selbst das Schrumpfgenom birgt viele Rätsel
Ohne das Verpflanzen eines Genoms in eine bereits funktionierende Zellinfrastruktur geht es bislang nicht. Und deshalb könne man auch nicht von künstlichem Leben sprechen, sagt Boldt. Erst wenn alle notwendigen Bestandteile des Lebens im Labor nachgebaut werden können, wäre seiner Auffassung nach der große Schritt getan. Andere Forscher versuchen sich dem Ziel "künstliches Leben" aus der entgegengesetzten Richtung zu nähern. Statt wie Venter von lebenden Zellen Teile zu entfernen, versuchen sie Minimalzellen aus einfachen Grundbausteinen zusammenzusetzen. Petra Schwille zum Beispiel, Direktorin am Max-Planck-Institut für Biochemie in Martinsried, konzentriert ihre Arbeit auf die Hülle der Zellen, und bereits das ist eine sehr schwierige Aufgabe. Wieder anders geht Nediljko Budisa mit einer Arbeitsgruppe an der TU Berlin vor: "Wir habe nicht das Geld, um künstliche Genome herzustellen, wie Craig Venter. Wir setzen deshalb Zellen gezielt unter evolutionären Druck, sodass sie so die gewünschten Eigenschaften entwickeln." Er freut sich aber über Venters Minimalzellen, die ihm die Arbeit erleichtern könnten. "Die Technologie ist da. Wir können heute nicht nur DNA sehr genau studieren, sondern auch in großem Maßstab künstlich herstellen." Die hohen Kosten sind auch für Harvard-Forscher George Church ein entscheidendes Argument gegen Venters Vorgehen. Er hält es für einfacher, natürliche Erbanlagen gentechnisch anzupassen, als alles künstlich herzustellen.
Und wie steht es um die Vermessung des Lebens? Trotz Computerdesign samt Komplettsynthese enthält auch das Genom von Syn 3.0 noch immer Rätsel. Von etwa einem Drittel der Gene, die sie in das Schrumpfgenom eingebaut haben, kennen Venters Leute die Funktion nicht genau. Immerhin sei die Quote niedriger als bei allen anderen bekannten Genomen, sagt Clyde Hutchison. Und bei den meisten könnten sie die Aufgabe zumindest erahnen. "Wir wissen zum Beispiel, wenn ein Gen am Transport eines Moleküls durch die Zellmembran beteiligt ist, aber wir wissen noch nicht, welches Molekül."
Langfristig wollen die Forscher aber auch die Aufgaben der restlichen Gene entschlüsseln und so das Phänomen "Leben" komplett beschreiben. "Wenn wir die Funktion jedes Gens verstehen, sollte es möglich sein, ein Computermodell der Zelle zu bauen, das vorhersagt, wie sich die Zelle in verschiedenen Umwelten verhält oder wenn neue Gene hinzugefügt werden", sagt Hutchison. Das ist dann wieder das, was man von Venter gewohnt ist: ein höchst ehrgeiziges Ziel.