Craig Mello hatte noch von "ferner Zukunft" gesprochen. Als der Nobelpreisträger vor einem Jahr seine Erwartungen an die neue Technologie namens Gene Editing schilderte, malte er ein neues Bild der Menschheit - befreit von Krankheiten wie Krebs und Diabetes. Immun gegen all jene gesundheitlichen Gefahren, die durch Gene bestimmt werden. Das Werkzeug namens Crispr-Cas9 könnte den ultimativ gesunden Menschen möglich machen. Nur eben nicht sehr bald. Sondern in dieser "fernen Zukunft".
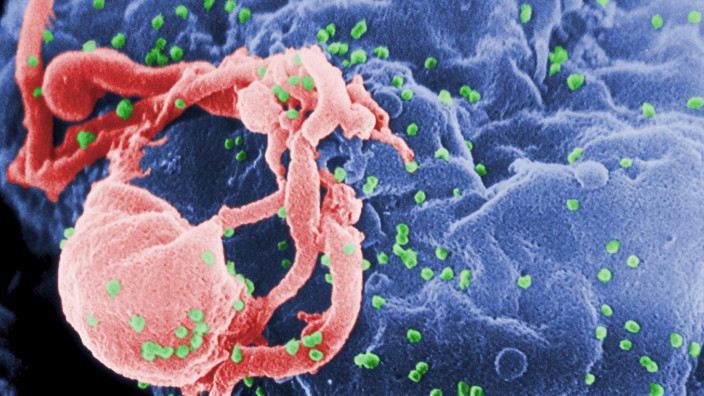
Doch wie es neuerdings so ist, in den Lebenswissenschaften: Mit Crispr-Cas9 geht alles schneller als gedacht. Chinesische Wissenschaftler haben mithilfe dieser Technologie schon jetzt menschliche Embryonen immun gegen den Aidserreger HIV gemacht. Wie die Forscher von der Universität in Guangzhou in der aktuellen Ausgabe der Fachzeitschrift Journal of Assisted Reproduction and Genetics berichten, gelang es dem Team, die Erbanlage für ein entscheidendes Molekül in den künstlich befruchteten Embryonen so zu verändern, dass das Immunschwächevirus nicht mehr in die manipulierten Zellen eindringen kann.
Zwar werden aus den veränderten Embryonen nicht wirklich Menschen erwachsen, die gegen HIV gefeit sind: Die Forscher haben für ihre Arbeiten nur Embryonen mit einem dreifachen Chromosomensatz eingesetzt. Solche Embryonen sind unter keinen Umständen lebensfähig. Dennoch zeigt das Experiment, wie leicht sich die Vision dank neuer Gentechnik umsetzen ließe. Und wie bisherige Erkenntnisse dabei genutzt werden können.
Aus den manipulierten Embryos werden zwar keine Menschen. Doch sie zeigen, was möglich ist
Die nun gezielt herbeigeführte Mutation tritt bei Menschen nämlich auch natürlich auf: Das sogenannte CCR5∆32-Allel war Mitte der Neunzigerjahre in Personen entdeckt worden, die sich auch bei intensivem Kontakt mit HIV nicht ansteckten. Inzwischen weiß man, dass die Mutation eine Andockstelle für HIV auf der Oberfläche von Zellen außer Gefecht setzt.
Zahlreiche Forschergruppen versuchen seither, den schützenden Effekt durch Medikamente zu simulieren. Oder sie arbeiten an der nachhaltigen Lösung des Problems - mit dem Ziel, ins Erbgut von bereits infizierten Patienten einzugreifen und den Rezeptor auszuschalten. Auf die Idee, Menschen per gezielter Veränderung des Erbguts bereits vor der Geburt vor einer Infektion durch HIV zu schützen - darauf war man lange nicht gekommen.
Es fehlte an genetischen Werkzeugen, die eine solche erforderliche Manipulation nicht nur theoretisch möglich machen könnten, sondern auch absehbar praktikabel. Erst die Entwicklung präziser Genscheren hat das verändert. Das erst wenige Jahre alte Werkzeug Crispr-Cas9 erlaubt derart präzise platzierte, kleine Schnitte im Erbgut, dass selbst der gezielte Eingriff an Embryonen keine Fiktion mehr ist. Die Methode gilt als hocheffektiv, extrem schnell und ist dazu noch kostengünstig. Do-it-yourself-Kits mit dem nötigen Zubehör sind online bereits für 160 Dollar erhältlich. In Labors kostet ein Crispr-Cas9-Einsatz nur etwa 30 Dollar. Andere Verfahren verschlingen mehrere Tausend Dollar je Versuch.
Kritik an Erbgutoptimierung
Es ist daher auch kein Wunder, das selbst weniger bekannte Labors wie das der Chinesen an der Universität von Guangzhou inzwischen über solche Techniken verfügen - und sie auch nutzen. Was aus den Versuchen jetzt folgt, bleibt allerdings abzuwarten. Der Biomediziner George Daley von der Harvard Medical School hat die Bedeutung der chinesischen Experimente im Fachblatt Nature bereits etwas heruntergespielt. Die Arbeit zeige im Wesentlichen, dass eine präzise Veränderung im Erbgut von Embryonen möglich ist. "Das wussten wir auch schon vorher." Es sei aber ein langer Weg, bis man alle Kopien eines Gens nach Wunsch verändern könne.
Auch Boris Fehse vom Universitätsklinikum in Hamburg-Eppendorf sieht die Versuche kritisch. "Ich wüsste nicht, welche Indikation es für einen solchen Eingriff geben sollte", sagt der Gentherapie-Experte. Es handle sich nicht um die Behandlung einer schweren Erbkrankheit, sondern um ein Enhancement, also eine Erbgutoptimierung. Eine, die nach Fehses Ansicht wenig Sinn ergibt. "Wozu soll man Menschen vor einer Krankheit schützen, die sie nicht sicher bekommen - und wenn, dann erst in 25 Jahren?"
Davon abgesehen glaubt der Mediziner nicht, dass die Manipulation durch Crispr-Cas9 jemals zu 100 Prozent effektiv sein wird. Daraus ergäben sich weitere Probleme. "Sie müssen dann massiv selektieren, welche Embryonen verwendet werden können. Im Tierversuch ist das vielleicht kein großes Problem. Aber beim Menschen bleibt es gerade im Zusammenhang mit einem Enhancement ethisch hochproblematisch."
Die Chinesen halten ihre Arbeit dennoch für wichtig. Es sei nötig, solche Versuche zu machen, um sich über die ethischen Implikationen klar zu werden. Wie die Forscher in ihrer Arbeit schreiben, lehnen sie eine klinische Anwendung derzeit jedoch rigoros ab.
So funktionieren die neuen Werkzeuge im Gentechnik-Labor
Der Schlüssel zum Erfolg des Genome Editing ist die Verbindung von scharfem Blick und herzhaftem Biss. Alle drei Methoden sind in der Lage, exakt definierte Stellen im Erbgut anzusteuern und den Doppelstrang der DNA an genau dieser Position vollständig zu durchtrennen. Auf diese Weise lassen sich einzelne Bausteine entfernen oder ganze Bausteinketten herausschneiden.
Zinkfingernukleasen, die ältesten Werkzeuge des Genome Editing, verteilen die Arbeit auf zwei Schultern. Der Zinkfingerteil des Eiweißes lässt sich so zusammensetzen, dass er direkt an das gewünschte Gen im Erbgut bindet. Die zweite Domäne, Nuklease genannt, schneidet dann an dieser Stelle los.
Eine Transcription-Activator Like Effector-Nuclease (TALEN) funktioniert fast genauso. Auch in diesem Protein herrscht Arbeitsteilung. Allerdings ist der Teil, der die Schnittstelle im Erbgut erkennt, leichter nach Wunsch zu gestalten als im Zinkfinger. Es gibt bereits riesige TALEN-Bibliotheken mit spezifischen Erkennungseiweißen.
Am einfachsten lässt sich DNA mit einer Kombination aus den unaussprechlichen Clustered Regulatory Interspaced Short Palindromic Repeats (CRISPR) und der Schere Cas9 verändern. Der Unterschied: Das System erkennt mithilfe einer Nukleinsäure, wo es im Erbgut schneiden soll. Diese RNA lässt sich fast beliebig gestalten. Manche Forscher sagen, Gentechnik sei deshalb nun so leicht wie Brötchenbacken.
Nach dem Schnitt bleibt noch was zu tun: Entweder schweißen die Reparaturkolonnen der Zelle die losen Enden der DNA zusammen. Das Ergebnis ist dann ein Verlust oder "Knockout", wie Forscher sagen. Oder es sind passende Ersatzschnipsel verfügbar, die in die Lücke eingebaut werden. Kathrin Zinkant