Wenn es wieder einmal gut schmeckt, wenn sich ein unwiderstehlicher Duft in der Nase ausbreitet, wenn der Vollmond eine romantische Atmosphäre zaubert - dann sollte man einen Moment innehalten und an den diesjährigen Chemie-Nobelpreis denken. Es gilt, sich jener kleinen Moleküle zu erinnern, die sich im Inneren jedes Menschen herumschlängeln und die genau dann, wenn es schön duftet, leuchtet oder schmeckt, ihre Arbeit verrichten. Ohne sie wäre der Mensch um vieles ärmer.
Diese Moleküle zu erschließen, die den wenig gefühlvollen Namen G-Protein-gekoppelte Rezeptoren (GPCR) tragen, dazu haben die beiden diesjährigen Chemie-Nobelpreisträger wesentlich beigetragen. Es handelt sich um den 69-jährigen Mediziner Robert Lefkowitz von der Duke University in North Carolina und um den 1955 geborenen Biochemiker Brian Kobilka von der Stanford-Universität in Kalifornien.
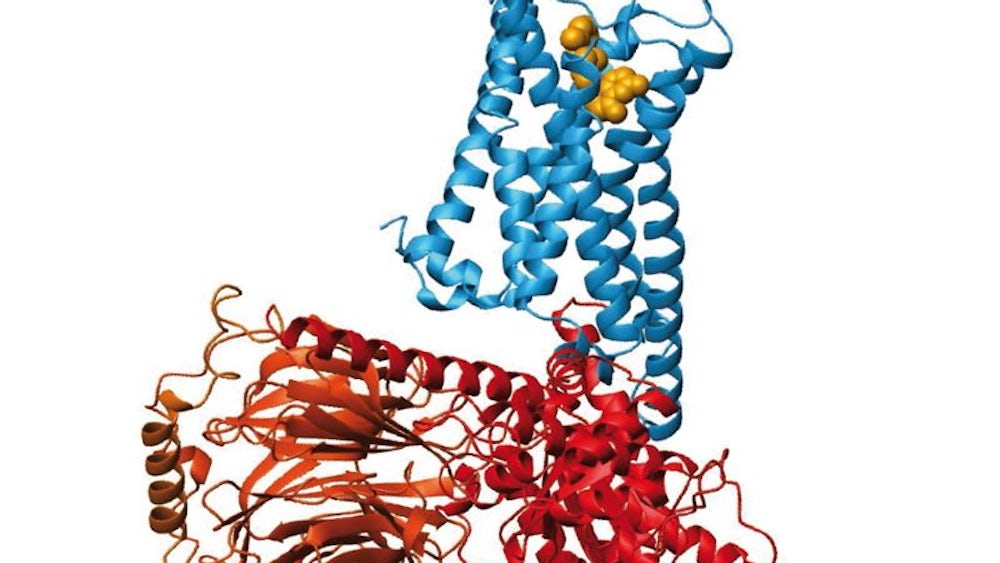
"Das Wissen über die GPCR gehört zum größten Gewinn der Menschheit", lobte die Königlich-Schwedische Akademie der Wissenschaften, als sie am Mittwoch die Preisträger verkündete. Etwa ein Drittel aller Medikamente wirke über diese Moleküle, darunter Betablocker, Entzündungshemmer und Psychopharmaka. Die GPCR sorgen auf vielfältige Weise für die Interaktion des Menschen mit der Umwelt - nicht nur, was Sinneseindrücke betrifft. Auch Hormone und hormonähnliche Botenstoffe wie Adrenalin, Serotonin, Histamin und Dopamin wirken über GPCR.
Weglaufen, wenn es gefährlich wird? Dazu muss das Herz schneller schlagen, der Blutdruck steigen, das Blut rein in die Muskeln. All das regeln die GPCR. Sowohl dass als auch wie sie es tun, haben Lefkowitz und Kobilka in mühevoller Arbeit herausgefunden.
Die Gemeinschaft der GPCR-Forscher ist begeistert über die Wahl. "Gestern auf einer Tagung in Würzburg haben wir noch gesagt, die beiden hätten es wirklich verdient", erzählt die Biochemikerin Annette Beck-Sickinger von der Universität Leipzig. Auch Peter Gierschik von der Universität Ulm, der in jungen Jahren mit Lefkowitz zusammengearbeitet hat, sagt: "Beide haben es extrem verdient." Lefkowitz habe bereits Ende der 1960er-Jahre mit seiner Arbeit zur Wirkung von Adrenalin begonnen, sagt Gierschik: "Und er ist bis heute ganz vorne mit dabei." Wenn er sich auf den neuesten Stand bringen wolle, schaue er zuerst, was Lefkowitz publiziert hat.
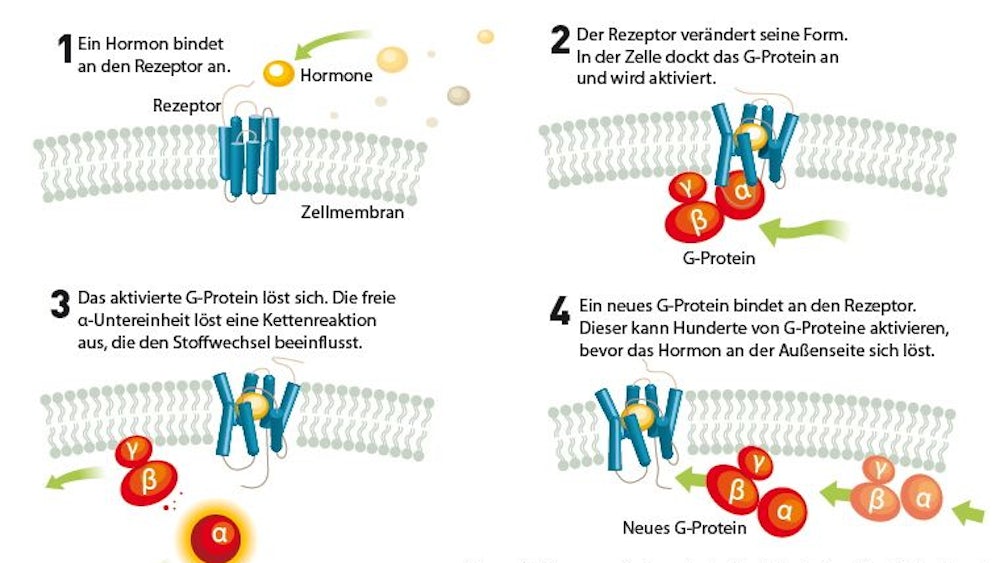
Die schlangenartigen GPCR-Moleküle durchziehen im Körper die Umhüllung der Zellen. Weil ein Teil von ihnen außen aus der Zelle herausragt und ein Teil innen, können sie Signale, die die Zellen etwa durch Hormone von außen erhalten, ins Zellinnere vermitteln. Ist das Hormon außen angedockt, bindet innen zunächst das namengebende G-Protein - und danach, das weiß man heute, eine Reihe weiterer Moleküle. "Es ist eine ganze Kaskade von Prozessen, die da abläuft", sagt Gierschik. Sie führt dazu, dass sich der Stoffwechsel der Zelle ändert und so Prozesse wie das Sehen oder das Riechen in Gang kommen.
Dass Adrenalin den Körper in Aufruhr versetzt, ist schon seit mehr als 100 Jahren bekannt. Aber wie nur kann dieses Hormon seine mannigfache Wirkung auf den Körper ausüben? Dieser Frage, die ihn gar nicht besonders interessierte, sollte Robert Lefkowitz Ende der 1960er-Jahre nachgehen. Damals hatte der Sohn eines Buchhalters gerade sein Medizinstudium beendet, manche seiner Freunde kämpften in Vietnam. Lefkowitz blieb das erspart, er durfte seinen Militärdienst forschend an den National Institutes of Health absolvieren.
Forschung - das war für den jungen Mann aus der Bronx, der schon als Kind seinen Hausarzt mit dem Stethoskop bewundert hatte und der Kardiologe werden wollte, besser als Krieg. Aber nur ein bisschen. "Ich hasste es ", erzählt er gerne. Ein Jahr lang mühte er sich ab, ohne etwas zu finden. Aber als dann doch der Erfolg kam und er erstmals eine Signalvermittlung mit Hilfe radioaktiv markierter Hormone nachweisen konnte, fing er Feuer. Seitdem ist Lefkowitz verrückt nach Forschung: "Ich verbringe den Tag damit, meine Mitarbeiter in den gleichen Wahnsinn zu treiben, in dem ich mich befinde", sagte er einmal.

Schon bald wurde er Gruppenleiter an der Duke University und stellte 1984 Brian Kobilka ein. Zusammen gelang es den beiden, das erste Gen eines GPCR zu klonieren. Was daraus abzuleiten war, begeisterte sie: Offenbar schlängelte sich dieses Molekül siebenmal durch die Hüllmembran der Körperzellen. So eine Struktur kannten sie doch? Sie erinnerte an Rhodopsin, jenes Seh-Pigment in der Netzhaut. Offenbar handelte es sich bei diesen Molekülen um eine ganze Familie! Die Interaktion des Menschen mit seiner Umwelt - vermittelt von sich siebenmal durch Zellmembranen windenden Proteinen. "Das war ein Heureka-Moment", erinnert sich Lefkowitz.
Inzwischen weiß man: Es ist sogar eine Großfamilie. Etwa 800 GPCR sind allein beim Menschen bekannt. Etwa die Hälfte von ihnen empfängt Gerüche, ein Drittel hormonähnliche Subtanzen; manche nehmen Lichtsignale auf und andere Geschmack. Wie aber muss man sich diese Schlangenungetüme genau vorstellen?
Dieser Frage widmete sich Brian Kobilka mit voller Hingabe, nachdem er 1989 selbst Professor geworden war. Man kann solche Moleküle nicht einfach unter dem Mikroskop anschauen. Dazu sind sie zu klein. Man muss viele Millionen von ihnen feinsäuberlich aus Zellen herauslösen und so dicht packen, dass sie einen Kristall bilden, durch den man Röntgenstrahlen schickt. Aus der Brechung der Strahlen lässt sich dann die dreidimensionale Struktur der Moleküle herauslesen.
Doch die Arbeit ist gerade mit Molekülen aus Zellmembranen unendlich mühsam. "Weil diese Moleküle Signale weiterleiten, sind sie nicht starr, sondern wackelig", erzählt Peter Gierschik. Erst 2007 gelang Brian Kobilka sein Lebensprojekt. Da hatten ihn seine Sponsoren schon aufgegeben. Aber Kobilka machte weiter: "Ich möchte einfach wissen, wie diese Proteine arbeiten; ich weiß auch nicht warum", sagte der Bäcker-Sohn. Ans Aufgeben habe er nie gedacht.
Wie in jedem Jahr wird die Verleihung des Chemie-Nobelpreises am 10. Dezember in Stockholm stattfinden. Robert Lefkowitz, da sind sich Forscherkollegen einig, wird den Tag genießen.
Und der äußerst zurückhaltende Brian Kobilka? "Es wird teuflisch werden, ihn nach Stockholm zu kriegen", prophezeit ein Weggefährte. Kobilka scheut das Rampenlicht. Er habe "furchtbar Angst", mit der Presse zu sprechen, hat er noch im vergangenen Jahr einer Journalistin des Magazins Nature gestanden. Er tue es nur, weil er "sicherstellen wollte, dass die Beiträge meines Labors und meiner Mitarbeiter wertgeschätzt werden". Dessen kann er sich jetzt sicher sein.